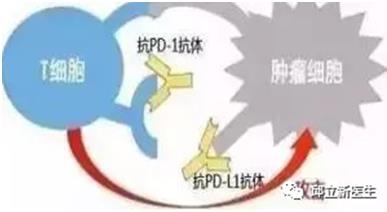
PD-L1与PD-1不同,PD-1可以与PD-L1又可以与PD-L2结合,所以阻断PD-1位点对免疫抑制的解除更彻底一些,但PD-L2更多的是在正常组织中表达,如果完全解除这一免疫抑制效应,会给正常组织细胞带来更多潜在的免疫损伤。PD-L1单抗只阻断PD-1~PD-L1通路,并不影响PD-1~PD-L2通路,避免间质性肺炎等副作用的发生。但最终效果与PD1类似,可以阻断PDL1与T细胞表面的PD1结合介导的免疫抑制,重新激发T细胞识别杀伤肿瘤细胞,从而抑制肿瘤生长。
在多项临床大数据中,PDL1单抗比PD1使用确实更加安全、低毒。
目前获批的PD-1/PD-L1进口药物主要有5种(PD-1药物:Keytruda和Opdivo,PD-L1药物:Tecentriq,Imfinzi和Bavencio)。PD-1药物就是我们俗称的K药和O药,目前已经在国内上市。PD-L1药物:Tecentriq,Imfinzi和Bavencio均已在国外上市,国内临床试验阶段。
今天给大家带来两大PD-L1单抗(I药和T药)已经在国外上市。它们在不同的癌种都有自己的一席之地。
“I”药篇
1、I药联合化疗给小细胞肺癌带来最长生存期,目前FDA已经获批
小细胞肺癌是一个恶性程度非常高的肿瘤。没有免疫治疗之前,局限期小细胞肺癌的总生存期(OS)为15-20个月,广泛期小细胞肺癌的生存期是9-11个月。2018年随着IMPOWER133研究结果的公布,免疫治疗阿特珠单抗+EP方案彻底改变了小细胞肺癌的治疗现状,目前国内和国外的治疗指南,一线SCLC的治疗是阿特珠单抗+EP方案。
今天邱医生给大家带来了另外一个好消息:免疫治疗I药+EP方案同样可以带来临床获益及生存期延长。
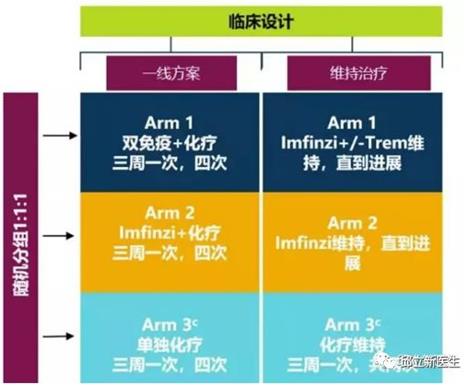
研究设计795位未经治疗的广泛期小细胞肺癌患者
分成三组:
l 一组接受双免疫(I药 1500mg d1+ tremelimumab 75mg d1)+EP方案化疗,
l 一组接受I药1500mg d1+EP方案化疗,
l 一组单独使用EP方案化疗
结果:
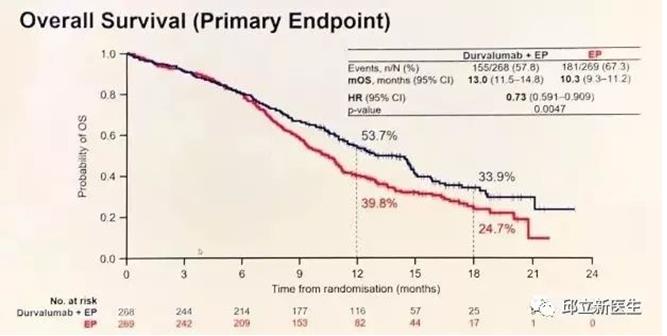
I药+EP化疗组,相比于单纯化疗组,一线治疗广泛期SCLC的中位OS有明显延长,分别为13个月及10.3个月,具有显著统计学差(HR=0.73,P=0.0047)。
目前标准的一线用药T药+EP化疗组的中位OS为12.3个月。相比于标准治疗,I药+EP化疗组延长了0.7个月的生存期。
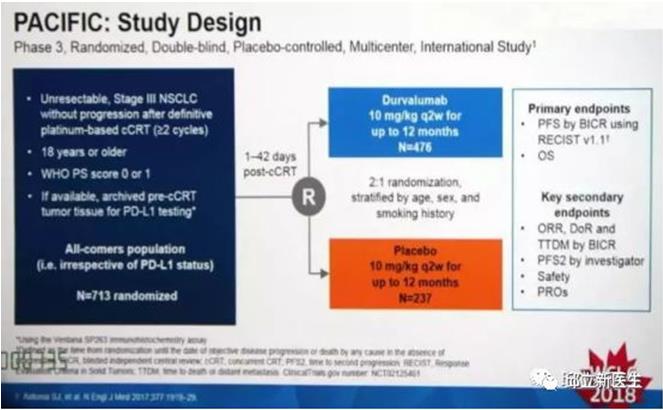
2、免疫治疗维持治疗临床研究---PACIFIC研究
PACIFIC是一项随机、双盲、安慰剂对照的III期多中心临床试验;旨在评估Durvalumab在经含铂方案同步放化疗后未发生疾病进展的局部晚期非小细胞肺癌(NSCLC)患者中巩固治疗的疗效。研究纳入713例患者,2:1比例随机分配至Durvalumab组(10 mg/kg,q2w)或安慰剂组。
与安慰剂相比,durvalumab显着延长了OS(HR,0.68; 99.73%CI,0.469-0.997; P =0 .00251)。durvalumab组未达到中位OS,安慰剂组为28.7个月。
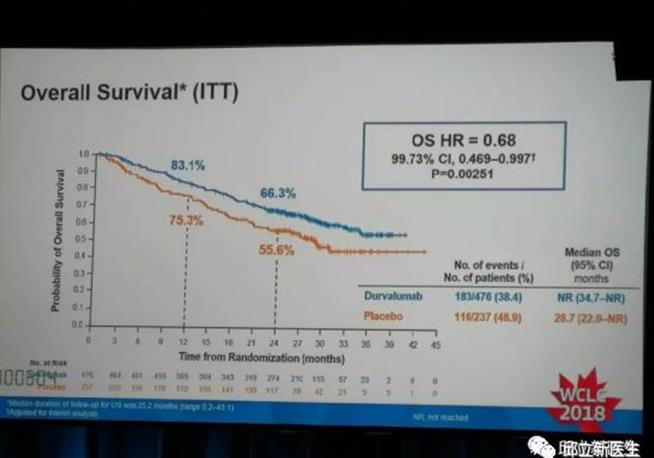
PACIFIC是第一项被证明可以给无法切除的III期非小细胞肺癌durvalumab维持治疗带来生存获益的研究;
PACIFIC临床试验结果显示,无论患者PD-L1表达高低,IMFINZI治疗都有效果。当然,如果PD-L1表达高一点,效果会更好。
3、I药联合CTLA-4抑制剂(tremelimumab)治疗治疗间皮瘤,疾病控制率为63%
接受一线或二线治疗的II期NIBIT-MESO-1 试验的40名晚期胸膜或腹膜间皮瘤患者,接受durvalumab 20mg/KG+tremelimumab 1mg/KG,4周一次治疗,共4个周期,随后进行9个周期的维持量durvalumab达到28%的免疫相关RECIST客观响应率。
结果显示,免疫相关疾病控制率(irDCR)为63%,疗效持续的中位时间为16.1个月。中位irPFS为8个月,中位OS为16.6个月。亚组分析发现患者的PDL1表达与预后无关。
4、I药对EGFR突变NSCLC患者有效
接受一线或二线治疗的II期NIBIT-MESO-1 试验的40名晚期胸膜或腹膜间皮瘤患者,接受durvalumab20mg/KG+tremelimumab 1mg/KG,4周一次治疗,共4个周期,随后进行9个周期的维持量durvalumab达到28%的免疫相关RECIST客观响应率。
结果显示,免疫相关疾病控制率(irDCR)为63%,疗效持续的中位时间为16.1个月。中位irPFS为8个月,中位OS为16.6个月。亚组分析发现患者的PDL1表达与预后无关。
5、I药联合联合雷莫芦单抗后线治疗非小细胞肺癌、肝癌及胃/胃食管癌
一项1期临床试验纳入了经治的晚期NSCLC、肝癌及胃/胃食管癌患者,使用I药联合雷莫卢单抗治疗。共纳入了28例NSCLC、28例肝癌及29例胃/胃食管癌患者。
肺癌患者中,有50%既往接受过一线治疗,25%接受过2线治疗,25%接受3-4线治疗。结果显示,NSCLC组的总ORR为11%,DCR为57%,中位PFS为2.7个月,中位OS为11个月。PDL1高表达(TC≥25%)人群的疗效更佳,中位OS达到16.4个月。
肝癌患者大部分为1线进展后(93%)。肝癌的总ORR为11%,中位PFS为4.4个月,中位OS为10.7个月。PDL1高表达人群的疗效显著,中位OS为16.5个月。
胃/胃食管癌患者72%接受过1线治疗。胃/胃食管癌的总ORR为21%,DCR为55%,中位PFS为2.6个月,中位OS为12.4个月。PDL1高表达人群的疗效显著,中位OS为14.8个月。
6、I药在女性肿瘤治疗中的优势
1)奥拉帕利+I药治疗BRCA突变晚期乳腺癌客观有效率63%!
MEDIOLA 的II期临床研究的乳腺癌队列中,探讨了奥拉帕利联合I药治疗BRCA1/2胚系突变的患者既往接受过铂类化疗,但是没有用过任何一款PARP抑制剂或PD1/PDL1单抗。
结果显示,有30名患者可进行疗效评估,12周的时候,控制率为80%,28周时,客观有效率为63%;起效的患者,疗效维持的中位时间为9.2个月,28周时疾病控制率为50%。总人群的中位OS为20.5个月,初治患者为21.3个月,既往接受过1线治疗为22.7个月,既往2线治疗患者为16.9个月。
2)I药联合奥拉帕尼治疗BRCA突变铂敏感卵巢癌,晚期控制率81%!
MEDIOLA的II期临床研究的卵巢癌队列中,探讨了奥拉帕利联合I药治疗BRCA1/2胚系突变铂类敏感性(既往至少接受过一线含铂化疗)晚期卵巢癌的疗效。
总共入组了32名三期或四期卵巢癌患者,这些患者是铂类化疗曾经敏感,后又复发的患者。既往必须至少接受过2种治疗方案,其中22名患者为BRCA1突变,10名患者为BRCA2突变。
结果显示,23名患者(72%)有效,其中6名患者肿瘤完全消失,17名患者肿瘤明显缩小,还有3名患者肿瘤稳定,总体的控制率达到了81%。
3)I药联合CTLA-4抑制剂(tremelimumab)治疗三阴乳腺癌的ORR为47%;
18名转移性乳腺癌患者接受I药+tremelimumab治疗,其中11例为ER(雌激素受体)阳性,7例为三阴性乳腺癌(TNBC)。
结果显示,总的客观缓解率(ORR)为17%,其中ER+的ORR为0%,三阴乳腺的ORR为47%,其中4例患者疗效持续超过10个月。
7、I药在男性肿瘤治疗中的优势
I药联合奥拉帕尼治疗去势抵抗型前列腺癌,1年的PFS率为51.5%!
2016.05-2017.05期间,17名既往接受过恩杂鲁胺和/或阿比特龙的去势抵抗型前列腺癌(mCRPC)患者入组,17名患者中,16名之前接受过恩杂鲁胺治疗,11名之前接受了阿比特龙治疗。10名患者之前曾接受过恩杂鲁胺和阿比特龙。
结果显示,17名患者中9名PSA下降≥50%,按照RECIST 1.1标准评估,4名患者为放射学反应。对于所有患者,12个月的PFS率为51.5%。
目前免费的Durvalumab临床研究
(可入组)
试验标题
Durvalumab用于一线非小细胞肺癌的研究
适应症
晚期非小细胞肺癌
试验目的
评估durvalumab相比标准治疗在下列参数的有效性:无进展生存期、总生存期
试验信息
试验分类:安全性和有效性
试验分期:III期
设计类型:随机分组
随机化:随机化
盲法:开放
试验范围:国际多中心
主要入选标准
1 筛选时,年龄≥18岁。
2在进行任何方案相关流程之前(包括PD-L1检测和其他筛选评估),从患者/法定代表获得书面知情同意。
3组织学或细胞学确认的IV期非小细胞肺癌(根据国际肺癌研究协会胸部肿瘤分期手册第7版;IASLC Staging Manual in Thoracic Oncology)。
4患者肿瘤必须缺乏EGFR敏感突变(即外显子19缺失,或外显子21 L858R、外显子21 L861Q、外显子18 G719X或外显子20 S7681突变)和ALK重排。
5随机分组之前,患者必须具有肿瘤细胞PD-L1高表达状态(新鲜标本或3个月内的归档样本)。
6入组时,东部肿瘤协作组(ECOG)体力状态评分为0或1。
7至少1个病灶(既往未接受过放疗),基线时经CT或MRI准确测量显示其最长直径≥10mm(淋巴结除外,淋巴结的短轴必须≥15mm),且依照RECIST v1.1指南,该病灶适合反复准确测量。
“T”药篇
1、T药在NSCLC新辅助治疗领域样本量最大的研究
试验总共入组了101名分期在IB-IIIB期,可以进行根治手术的NSCLC患者,患者,Atezolizumab 1200 mg,每3周静脉给药1次,两次注射后进行手术。手术有效的患者将继续第二部分的探索性研究,接受Atezolizumab 12个月的辅助治疗。
结果显示,在接受手术的90例患者中,7%为部分缓解(PR),89%为疾病稳定(SD),40%-50%的EGFR/ALK阳性患者出现病理缓解。
同时,Atezolizumab作为新辅助治疗的安全性和耐受性也较好,≥3级的与免疫相关的不良反应发生率为6%。
2、单药一线治疗晚期NSCLC取得OS延长
IMpower110研究是一项III期、开放性、随机对照、全球多中心临床试验,比较阿特利珠单抗单药相比铂类(顺铂或卡铂)联合培美曲塞或吉西他滨用于经PD-L1筛选的IV期非小细胞肺癌初治患者。
该研究总共纳入572例患者,其中555例患者无EGFR/ALK突变(WT)。按1:1随机分成两组,分别接受:
免疫治疗组:阿特利珠单抗1200mg静脉输注,每三周一次,直至疾病进展、不可接受的毒性或临床获益消失。
标准化疗组:顺铂或卡铂(研究者决定)联合培美曲塞(非鳞癌)或吉西他滨(鳞癌),4至6个周期后可采用培美曲塞单药维持(非鳞癌)或最佳支持治疗(鳞癌)直至疾病进展、不可接受的毒性或死亡。
研究结果
中位随访时间15.7月。与标准化疗相比,阿特利珠单抗显著改善PD-L1高表达(TC3/IC3-WT)IV期非小细胞肺癌初治患者的中位OS:20.2月vs13.1月,HR=0.59(95%CI:0.40,0.89),P=0.0106;两组的12个月OS率分别为64.9%vs50.6%;中位PFS分别为8.1月vs5.0月,HR=0.63(95%CI:0.45,0.88),P=0.007;两组的12个月PFS率分别为36.9%vs21.6%。
从公布的数据来看,相较化疗,阿特珠单抗一线治疗PD-L1高表达患者延长生存获益明显。
3. FDA批准阿特珠单抗联合化疗一线治疗PD-L1阳性的三阴乳腺癌
IMpassion130试验,该试验纳入了902名转移性或局部晚期三阴性乳腺癌患者,这些患者无法通过手术切除。随机分配接受atezolizumab+nab-paclitaxel(白蛋白紫杉醇)或安慰剂+nab-paclitaxel。
在整个患者群体中,接受atezolizumab+nab-paclitaxel与仅接受化疗的患者相比患者的无进展生存期明显增加,分别为7.2 VS 5.5个月。
在PD-L1 ≥1%亚组中,atezolizumab显着降低了疾病进展或死亡的风险(中位PFS = 7.5对5.0个月; P<.0001)。免疫疗法也显著改善了中位OS(25.0对15.5个月),延长近一倍。安全性方面与研究药物的安全性一致。
转自邱立新医生微信公众号
