中国国家癌症中心公布的数据,中国结直肠癌发病率在升高。其中发病率:男性第五,女性第四。每年约37.6万人诊断为结直肠癌,平均每天约1000人被确诊!其中发病率主要集中在 60~74 岁的年龄范围,占总体发病人数的 41.23%,而 45 岁以上发病的患者占所有结直肠癌新发病例的 93.28%。三分之一的患者初诊时已经是晚期。
以横结肠的脾曲为界,结肠癌分为左半结肠和右半结肠。左半结肠包括远端1/3的横结肠、降结肠、乙状结肠和直肠,右半结肠包括盲肠、升结肠和近端2/3的横结肠。
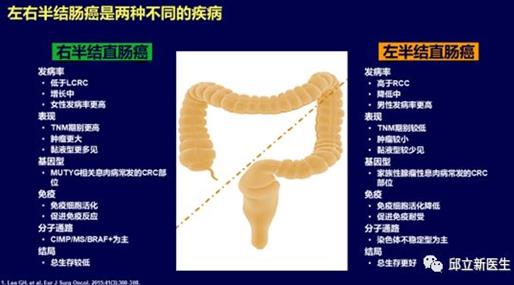
左半结肠和右半结肠具有不同的分子生物学特点和预后

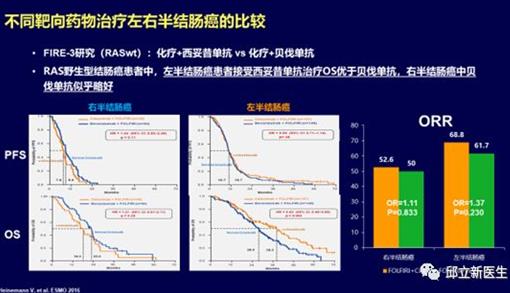
近期有较多回顾性研究数据表明原发瘤位于右侧(回盲部到脾曲)的转移性结肠癌预后明显差 于左侧者(自脾曲至直肠)。对于 RAS 基因野生型的患者,抗 EGFR 单抗(西妥昔单抗)的疗 效与肿瘤部位存在明显的相关性,暂未观察到抗VEGF单抗(贝伐珠单抗)的疗效与部位存在 明显关联。比较化疗联合贝伐珠单抗或西妥昔单抗的头对头随机对照研究的回顾性亚组分析数据显示:在左侧结直肠癌,西妥昔单抗在客观有效率和总生存上均优于贝伐珠单抗;而在右侧结肠癌,西妥昔单抗虽然在客观有效率上可能存在一定优势,但在总生存上不如贝伐珠单抗。
晚期肠癌不是不治之症,很多患者经过积极的内科治疗后获得了手术的机会,获得了长期生存。
对于潜在可切除的患者,应选用 5-FU/LV(或卡培他滨)联合奥沙利铂或伊立替康的方案加分子靶向治疗,或高选择性患者可谨慎使用强力的 FOLFOXIRI± 贝伐珠单抗方案。转化治疗应密切评估转移灶可切除性,建议每 6~8 周行一次影像学评估,如转移灶转变成可切 除时,即予以手术治疗。
维持治疗:潜在可切除组如果接受转化治疗超过半年后转移灶仍无法 R0 切除,不建议手术切除,建议化疗±靶向的维持治疗。维持治疗选择的药物毒性低同时使用方便的药物,如5-FU/LV 或卡培他滨单药 ± 贝伐珠单抗或暂停全身系统治疗。
国内晚期结直肠癌治疗(CSCO指南)
潜在可切除治疗
1) RAS和BRAF野生型,原发灶位于左侧结直肠癌 FOLFOX/FOLFIRI± 西妥昔单抗。原发灶位于右侧结直肠癌 FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;FOLFOXIRI± 贝 伐珠 单 抗 。
2) RAS和BRAF 突变型 不分左右半结肠,FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;FOLFOXIRI± 贝 伐 珠 单 抗
姑息患者的治疗
一线治疗:
RAS和BRAF野生型 原发灶位于左侧结直肠癌 FOLFOX/FOLFIRI± 西妥昔单抗。原发灶位于右侧结直肠癌 FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;
RAS和BRAF 突变型 不分左右半结肠,FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗。
二线治疗:
一线接受 奥沙利铂治疗(RAS 和 BRAF 均 野生型)FOLFIRI± 靶向药物 (西妥昔单抗 或 贝伐珠单抗 );
一线接受 伊立替康治疗(RAS 和 BRAF 均 野生型)FOLFOX± 靶向药物 (西妥昔单抗 或 贝伐珠单抗),CapeOx± 贝伐珠单抗 ;
一线接受 奥沙利铂治疗(RAS 或 BRAF突 变型)FOLFIRI±贝伐珠单抗;
一线接受 伊立替康治疗(RAS 或 BRAF 突 变型)FOLFOX/CapeOx±贝伐珠单抗;
一线未接受 伊立替康或奥沙利铂治疗 FOLFOX/FOLFIRI±靶向药物(西妥昔单抗或贝伐珠单抗 )、CapeOx± 贝伐珠单抗;
三线治疗:
瑞戈非尼、呋喹替尼或者临床试验
福利时间
目前正在进行的临床研究
(可入组)
试验标题
重组全人源抗EGFR单克隆抗体注射液治疗ras野生型晚期结直肠癌患者的安全性及有效性的Ib/II期临床试验 。
适应症
远处转移或无法行根治性切除的局部晚期结直肠癌一线治疗患者
试验信息
试验分类:安全性和有效性
试验分期:Ib/II期
随机化:随机化
盲法:开放
试验范围:国内多中心试验
主要入选标准
1、自愿签署书面知情同意书;
2、远处转移或无法行根治性切除的局部晚期结直肠癌一线治疗患者;
3、经组织和/或细胞病理学确认的结肠或直肠腺癌;
4、肿瘤组织(K-ras、N-ras)基因野生型,且未发现BRAF V600E突变;
5、经CT或MRI证实,至少存在一个符合RECIST 1.1标准的可测量病灶(非放射治疗野);
6、男性或女性,年龄18~75岁(含18岁和75岁);
7、美国东部肿瘤合作组体力状况评分(ECOG PS)≤1(0-1);
8、预计生存期不少于12周;
9、骨髓储备、肝功能、肾功能必须符合以下要求:HGB≥90g/L;ANC≥1.5×109/L;PLT≥90×109/L;TBIL≤1.5×ULN;AST和ALT均≤2.5×ULN,或伴肝转移受试者的AST和ALT应≤5 x ULN;Cr≤1.5×ULN;
目前正在进行的临床研究
(可入组)
试验标题
评价曲氟尿苷替匹嘧啶片与TAS-102对比在肠癌患者生物等效
适应症
远处转移或无法行根治性切除的局部晚期结直肠癌治疗患者
试验信息
试验分类:安全性和有效性
试验分期:其它
随机化:随机化
盲法:双盲
试验范围:国内多中心试验
主要入选标准
1、年龄 18-70岁(包含边界值),男女不限
2、病理组织学证据证实为结肠或者直肠腺癌
3、首次用药前4周内未接受全身系统性的抗肿瘤治疗(包括但不限于系统的化疗、生物免疫治疗、分子靶向治疗、激素治疗等)或首次给药前2周内未进行过有明确抗肿瘤作用的现代中药制剂治疗
4、预期生存期超过3个月
5、东部协作癌症组(ECOG)体能状态评分为0分或1分
6、能够口服药物(即未使用饲管)
7、根据首次用药前7天内获得的下列实验室检测值,具有适当的器官功能。a. 血红蛋白(HB)≥100 g/L;b. 中性粒细胞绝对值(ANC)≥1.5×109/L;c. 血小板(PLT)≥80×109/L;d. 总血清胆红素(TBIL)≤1.5倍正常值上限(ULN) ;e. 丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶AST≤2.5×ULN,如伴肝转移,则ALT和AST≤5×ULN;f. 血清肌酸酐≤132.6 μmol/L
8、育龄期女性患者首次用药前7天内的尿妊娠检查结果阴性,且必须同意在研究期间采取充分有效的避孕措施直至研究药物中止后6个月;而男性患者必须同意在研究期间采取充分有效的避孕措施直至研究药物中止后6个月
9、患者自愿参加本研究,并且签署知情同意书,依从性好,能配合试验观察
转自邱立新医生微信公众号
