
PD-1受体是程序性死亡分子,表达于活化的T细胞、B细胞和NK细胞等表面,其配体PD-L1可在多种实体瘤中表达。当PD-1与肿瘤细胞表面的PD-L1结合后,能够产生抑制信号,就像踩下了刹车,阻止效应性T细胞增殖,使其不能杀灭肿瘤细胞,帮助肿瘤细胞逃脱免疫系统的监视与杀伤,从而发生“免疫逃逸”。而PD-1/PD-L1抑制剂可阻断PD-1与PD-L1的结合,通过恢复T细胞的杀伤反应,促进T细胞活化增殖,抑制T细胞衰竭,就像踩下了T细胞的“油门”,促进T细胞进一步杀伤肿瘤,从而实现抗肿瘤治疗的目的。
单从作用机制而言,PD-1/PD-L1抑制剂抗肿瘤的原理其实很简单,为什么大家对其仍如此推崇呢?原因在于PD-1/PD-L1抑制剂疗效的持久性。
免疫应答具有“免疫循环”的优越性,具体而言:肿瘤细胞释放肿瘤抗原至肿瘤微环境中,肿瘤抗原吸引并活化肿瘤抗原特异性T细胞识别和杀伤肿瘤细胞。肿瘤细胞死亡后又释放新的肿瘤抗原,产生“免疫循环”。通过对肿瘤抗原的不断识别和记忆,免疫应答会随着时间的延长而发展和增强。因此,有理由猜想,免疫治疗的疗效反应模式或许有别于传统治疗药物。考虑到免疫系统的这种记忆性,一旦PD-1/PD-L1抑制剂起效,患者具有潜在的临床治愈性,进一步观察免疫治疗患者的OS数据,也存在明显的“长拖尾”效应,也就是说,可以5年、10年内不复发、不进展、长期生存。对于很多患者而言,无异于是天大的好消息。
但是,立足于当下来看,免疫治疗还没有那么的普及,为什么?撇开价格昂贵这一条不谈,很大原因在于目前没有明确的准确疗效预测因子,患者在开始治疗之前,心里都是没有底的,往往抱着试一试的心态,尝试一下。而更多的患者则是在“不确切的疗效”+“昂贵的价格”两个因素的影响之下,最终选择了其他的治疗方案。之前的文章中我们谈到过,PD-L1表达量、肿瘤突变负荷(TMB)、MSI /MMR、肿瘤浸润T细胞含量、中性粒细胞-淋巴细胞比率、是否接受过放疗、基因突变与是否吸烟等都有可能预示着患者的疗效,但这些因素又充满着不确定性。以PD-L1为例,尽管PD-L1表达状态识别出更有可能受益的患者,但是PD-L1状态会受到随时间的动态变化,肿瘤内异质性以及使用不同阈值的PD-L1阳性的各种测试方法的可用性的影响。所以最后只能将各项因素综合起来,再根据患者实际身体情况最终判定是否要选择免疫治疗。
现在的状况是,疗效预测因素有很多,不确定性也有很多,作为家属/患者而言在开始治疗之前当然是了解得越多越好,今天立足于CA209-003研究再跟大家聊一聊何种因素才是大家使用免疫治疗能够获得更长生存期的关键。总结起来有以下几点:
1. 基线时更佳的身体状态
2. 基线时无骨转移、肝转移
3. 基线时靶病灶直径总和小
4. 治疗过程中可测量靶病灶的肿瘤负荷减少程度
5. 治疗过程中出现了不良事件(AEs)
6. 基线ALC高
长期生存获益是晚期NSCLC的主要治疗目标,既往的数据显示,晚期NSCLC的5年生存率不足5%,纳武利尤单抗突变治疗瓶颈,将晚期NSCLC的5年生存率提升至16%,使患者长期生存成为可能,这是晚期肺癌治疗史上又一里程碑式的进展。CA209-003研究作为首个PD-1抑制剂治疗NSCLC的临床试验,是目前随访时间最长的一项研究。
CA209-003研究是一个多中心的I期,剂量递增的扩展队列研究,旨在评估nivolumab用于晚期NSCLC,黑色素瘤,肾癌,结直肠癌或趋势抵抗的前列腺癌的疗效和安全性。
入组患者接受nivolumab 1,3或10mg/kg,q2w治疗,共8个治疗周期。在剂量扩展期中,NSCLC患者根据组织学类型进行分层,患者持续接受治疗直至12个周期或不可耐受的毒性或确认的CR或确认的PD或要求出组,最大治疗持续时间为96周。患者进展后若无临床恶化,允许其继续治疗。
纳入本次分析的270例患者中,黑色素瘤患者有107例(39.6%),RCC患者34例(12.6%),NSCLC患者129例(47.8%)。结果如下:
➤黑色素瘤:ORR为31.8%;5年OS率为34.2%(95%CI,25.2%-43.4%);
➤RCC:ORR为29.4%;5年OS率为27.7%(95%CI,13.9%-43.5%);
➤NSCLC:ORR为17.1%;5年OS率为15.6%(95%CI,9.6%-22.9%)
回顾分析发现,某些因素或许是大家使用免疫治疗能够获得更长生存期的关键。
1. 基线时更佳的身体状态,预示着更长的生存期
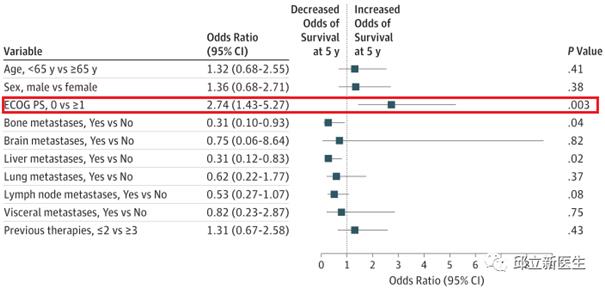
在多变量分析中,ECOG表现状态为0(OR,2.74; 95%CI,1.43-5.27; P = .003)与5年生存率增加相关。
ECOG评分标准,是从患者的体力来了解其一般健康状况和对治疗耐受能力的指标。ECOG体力状况评分标准记分 0分、1分、2分、3分、4分和5分。
各个分值级别对应的体力状态为:
0分:活动能力完全正常,与起病前活动能力无任何差异。
1分:能自由走动及从事轻体力活动,包括一般家务或办公室工作,但不能从事较重的体力活动。
2分:能自由走动及生活自理,但已丧失工作能力,日间不少于一半时间可以起床活动。
3分:生活仅能部分自理,日间一半以上时间卧床或坐轮椅。
4分:卧床不起,生活不能自理。
5分:死亡
分值越低对应着越好的身体状态,ECOG表现状态为0,也就是活动能力完全正常,与起病前活动能力无任何差异的状态。这也就是为什么很多医生建议患者及家属尽早使用免疫治疗的原因,等到患者真的已经到了卧床不起的状态时再使用,生存获益肯定不如早用。
另外临床上还有另一种常见的体力状况评分标准,是Karnofsky(卡氏,KPS,百分法)功能状态评分标准,与ECOG体力状况评分标准不同的是KPS评分分值越高意味着越好的身体状态。
各个分值级别对应的体力状态为:
100分:正常,无症状和体征
90分:能进行正常活动,有轻微症状和体征
80分:勉强可进行正常活动,有一些症状或体征
70分:生活可自理,但不能维持正常生活工作
60分:生活能大部分自理,但偶尔需要别人帮助
50分:常需人照料
40分:生活不能自理,需要特别照顾和帮助
30分:生活严重不能自理
20分:病重,需要住院和积极的支持治疗
10分:重危,临近死亡
0分:死亡
按照这个评分标准来说,得分越高,健康状况越好,越能忍受治疗给身体带来的副作用,因而也就有可能接受彻底的治疗。得分越低,健康状况越差,若低于60分,许多有效的抗肿瘤治疗就无法实施。
2.基线时无骨转移、肝转移的患者,生存获益更佳
在多变量分析中,基线存在肝转移(OR,0.31; 95%CI,0.12-0.83; P = .02)或骨转移(OR,0.31; 95%CI,0.10-0.93; P =. 04)会导致5年生存率降低
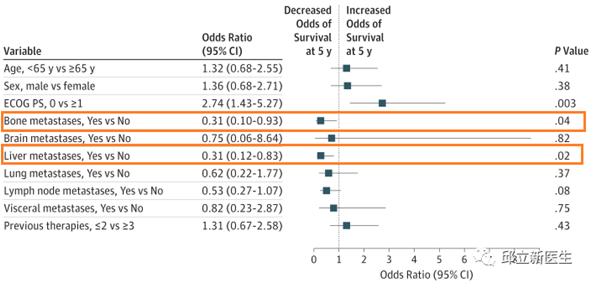
此前的文章也有写到,美国加利福尼亚大学的AdilDaud教授,从4个著名的接受PD-1抗体K药治疗的前瞻性临床试验(Keynote001、Keynote002、Keynote006、EAP)中收集了数百名资料齐全的恶性黑色素瘤、非小细胞肺癌患者的相关信息,并进行了严谨的分析。他首先选择了223名晚期恶性黑色素瘤患者作为训练集(其中有151名患者不合并肝转移、72名患者合并肝转移),探索可能会影响PD-1抗体疗效的指标,发现是否合并肝转移时其中非常突出的一个指标:合并肝转移的患者,出现疾病进展的风险高1.85倍;两组的中位无疾病进展生存期分别是20.1个月和5.1个月,最佳有效率分别是70.8%和47.5%。合并肝转移的患者,明显疗效更差。IMpower131研究亚组分析结果也表明,与卡铂联合白蛋白紫杉醇相比,无肝转移组患者加用Atezolizumab较有肝转移组疗效更加显著。
但是,也有一些研究表明,虽然肝转移患者整体预后劣于不伴肝转移的患者,但相较现有治疗,伴有肝转移的患者仍然可以从免疫治疗中获益(比如Nivolumab)。CheckMate 017 & 057研究汇总分析显示,与多西他赛相比,Nivolumab改善了肝转移患者的OS,与整体研究人群的结果一致。而IMpower150研究是一项多中心、开放、随机、对照的III期临床研究,也是全球第一个抗血管生成药物联合免疫一线治疗晚期NSCLC的III期试验。该研究结果显示,相比于贝伐珠单抗+化疗,Atezolizumab+贝伐珠单抗+化疗能给ITT-WT患者和基线伴肝转移的人群均带来PFS和OS获益。所以,虽然肝转移患者被公认为不是肿瘤免疫治疗的优势人群、且肝转移患者人群总体预后不如无肝转移的患者,但不代表肝转移患者无法从免疫治疗中获益,相比于化疗而言,免疫治疗也许是肝转移患者更好的选择。
骨转移也是如此,意大利的Federico Cappuzzo在《肿瘤免疫治疗》杂志上发表的一项最新研究显示:骨转移可能会独立地影响疗效和生存期。基线时就有骨转移的患者,获益比无骨转移的患者更差。但是,再对比当下的其他治疗方式来说,存在相关转移的患者,仍然能从免疫治疗当中获益,只是总体获益略低于不伴相关转移的患者人群。因此,如果存在骨转移/肝转移,还是建议慎重考虑。
3.基线时靶病灶直径总和越小,生存时间可能越长
基线时靶病灶直径总和越大,也就是基线肿瘤负荷更大的患者(参考依据:基线靶病灶直径总和),5年生存率更低;。对那些使用O药5年还存活的患者统计,他们中位靶病灶直径总和为88.0 mm;而那些5年后已经死亡的患者,他们的中位靶病灶直径总和为109.0 mm。
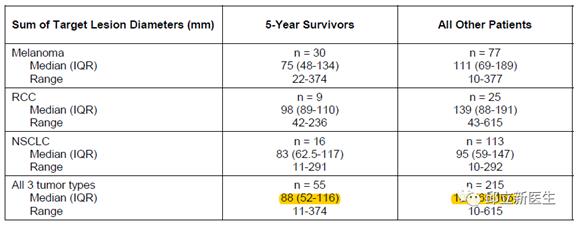
其实这一条也可以与前面的体力状态评分相联系,一般而言如果患者基线时的肿瘤负荷越大,那么他的基线时的体力状态评分也是越差的。而且,治疗前肿瘤的大小决定了需要多强的免疫反应。肿瘤越大,需要PD-1/PD-L1抑制剂去激发更多的免疫细胞去攻击肿瘤病灶。很多患者经历临床治疗失败,有时并不是因为PD-1/PD-L1抑制剂无法刺激免疫系统,也可能是激活的免疫细胞达不到与之对抗的数量。以少赢多不太现实。
4.治疗过程中可测量靶病灶的肿瘤负荷减少程度
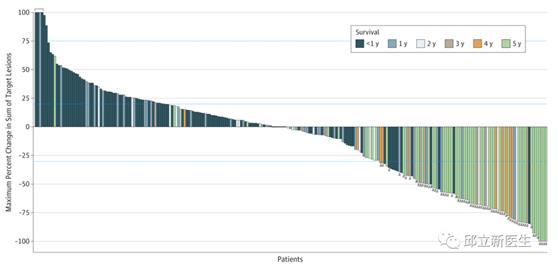
在有可用影像资料的245名患者中,我们观察到可测量靶病灶的肿瘤负荷减少程度似乎与长期生存直接相关。分析显示,ORR和5年生存率之间存在显著关联,5年时存活的55例患者中有41例达到客观缓解。5年时死亡的 215 例患者中只有25例达到了客观缓解(OR, 22.3; 95% CI, 10.7-46.5; P < .001) 。
5.治疗过程中出现了不良事件(AEs)
很多患者期望在采用相关治疗的时候,能够只杀伤肿瘤细胞,不影响身体其他正常细胞,没有任何不良反应。邱医生也希望如此,但是实际上却是不太可能。用一句老话来说“是药三分毒”,不良反应似乎是抗肿瘤治疗过程中绕不过去的一个坎。但是,最新的一些数据表明,不良反应的发生,似乎是预示着疗效。
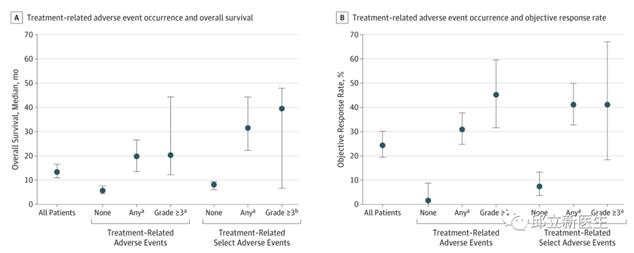
在免疫治疗中,大家发现,不良反应的发生,预示着更好的生存获益。从下图可以看出,与没有出现治疗相关AE的患者相比,出现任何级别或3级及以上治疗相关AE的患者总生存期显著延长。
所以,现在不怕出现不良反应,如果出现了,可能预示着更好的疗效,只要不良反应处理得当,对于患者整体的获益来说,是有利无弊的。但即便如此,对于免疫相关不良事件,我们也不可掉以轻心,免疫相关不良事件有以下几个特点:
多数免疫相关不良反应为轻中度
轻症患者可没有症状,严重毒性可以危及生命,早期识别是关键。
发生不良反应时间不同; 可以在治疗结束后发生。
多数反应应用激素后可以逆转;一些毒性反应可能需要中断治疗。
所以对医护团队、患者、看护人员进行免疫相关不良反应症状、体征的教育至关重要。把控好不良反应,才是患者长期获益的保障。
6.基线ALC高
分析显示,与没有客观缓解的患者相比,出现客观缓解(完全缓解和部分缓解的患者平均基线绝对淋巴细胞计数(ALC)明显更高。此外,基线ALC低于正常下限(850cells/μL)的患者比例低于无应答患者(16.9%对25.2%)。治疗前血液中的淋巴细胞数目较多的患者(1546 vs 1290个/μL),更有机会存活5年,而且血液中的调节性T细胞的平均数目也显着更高(49.5 vs 32.6 个/μL)。
免疫细胞与PD-1疗效的关系,与肿瘤太大、免疫细胞不够,属于同一类范畴。淋巴细胞是人体主要的免疫活性细胞,包括B淋巴细胞和T淋巴细胞,还有自然杀伤细胞等等。而调节性T细胞通常起着维持自身耐受和避免免疫反应过度损伤机体的重要作用。简单来说,免疫治疗还是在一定程度上依赖于人体自身的免疫系统的。调控PD-1/PD-L1等于是调控T细胞的刹车和油门,如果T细胞大军总数极低,你再怎么去加速、去促进,整体的抗击肿瘤的效果也不会太强。
而且大部分患者在接受PD-1治疗时,或已接受过诸如放疗、化疗的治疗,血液中免疫细胞数目已经减少,其实在这种时候再去使用免疫治疗,疗效也不如最早的时候强,这也就再次回到了开头所提到的:免疫治疗要趁身体好,要趁早。
现在已经是2020年,距离2006年PD-1首次开展临床试验,已经过去了14年,最早那批使用PD-1治疗的患者目前都已经陆续有相关数据公布,也给大家带来了一个接一个的希望。但是,我还是建议,大家在开始免疫治疗之前,一定要充分去了解它。比如,出现不良反应你能接受吗?出现“假性进展”你能接受吗?短时间内无明显疗效(肿瘤无变化),你能接受并继续耐心使用观察等待吗?这些问题,大家一定要在开始治疗之前给自己一个准确的答案。不要盲随大流,事后再来后悔,治疗中途随意、随心更改方案,对于患者和医生来说都是极其不负责任的行为。
最后的最后,免疫治疗是一类创新的抗肿瘤治疗模式,仍有众多未知有待我们探索,也期待与大家一起见证免疫治疗带来的奇迹!
转自邱立新医生微信公众号
