非小细胞肺癌患者迎来第五款免疫治疗药物,近期美国FDA已经授予Libtayo(西米普利单抗)优先审查资格。审批的适应症为:用于治疗PD-L1表达水平≥50%的晚期非小细胞肺癌患者。时间大约为2021年2月,也就是时候非小细胞肺癌患者将在明年2月有望用上新的免疫治疗药物。
FDA已经批准了哪些免疫检查点抑制剂?
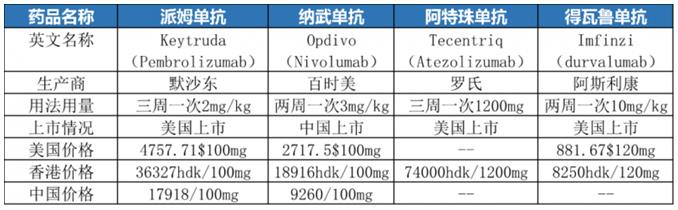
免疫检查点抑制剂是近年来治疗非小细胞肺癌的有效疗法之一。目前获批用于肺癌的四大PD-1/L1免疫检查点抑制剂分别为:帕博丽珠单抗,纳武利尤单抗,阿特朱单抗,得瓦鲁单抗。免疫检查点抑制剂成功将晚期肺癌不到5%的5年平均生存率,提升至16%,为不少患者带了生存的希望。也因此免疫疗法成为非小细胞肺癌炙手可热的新型疗法。
西米普利单抗
西米普利单抗是一款针对PD-1靶点的单克隆抗体药物。通过与PD-1结合,西米普利单抗能够接触癌细胞对于T细胞的抑制重新激活T细胞,增强T细胞对于癌细胞的杀伤能力,达到抗癌的效果。西米普利单抗已经与2年前获批用于治疗皮肤鳞状细胞癌。
死亡风险降低32%,西米普利单抗进军非小细胞肺癌一线治疗!
在2020年ESMO大会上发表的代号为EMPOWER-Lung 1的III期最新试验数据显示,对于晚期非小细胞肺癌(NSLSC)的患者,尤其PD-L1高表达的患者,当西米普利单抗(cemiplimab)作为一线治疗时,与铂类化疗相比,可显着延长总体生存期和无进展生存期。
实验设计:
这项III期临床试验纳入了710名晚期非小细胞肺癌患者,这些患者均为无法接受手术或者化学药物治疗,或者经化疗后病情出现进展,以及未经治疗的转移性非小细胞肺癌患者,其中有10%的患者出现脑转移。将患者随机分配至铂类化疗组和西米普利单抗组。主要终点为总生存期和无进展生存期(PFS)。
试验结果:
在意向治疗组中,西米普利单抗将死亡风险降低了32%。此外,在西米普利单抗组与化疗组中的对照结果显示,疾病进展的风险降低了41%,中位PFS时间分别为6.2个月和5.6个月。总体缓解率为37%vs21%,中位总体生存时间分别为22.1个月和14.3个月。在PD-L1表达水平≥50%的患者亚组分析中,西米普利单抗将死亡率降低了43%,疾病进展的风险降低了46%,PFS时间分别为8.2个月和5.7个月,总缓解率为39%vs20%。根据研究结果显示,西米普利单抗的总体缓解率与PD-L1表达密切相关。在PD-L1表达水平≥90%的缓解率为46%,6个月后患者的肿瘤消退可达40%以上。
安全性:
在接受西米普利单抗治疗的患者中,贫血,疲劳,肺炎,食欲下降,便秘和恶心是最常见的不良反应。试验过程中未发现出现严重不良反应的患者。
参考资料:
https://www.cancerhealth.com/article/libtayo-notably-improves-survival-people-advanced-lung-cancer
