从2018年6月15日,“O药”(Opdivo,Nivolumab)在国内获批,免疫治疗的大门就此打开。后续国内也陆续上市了N款免疫治疗相关药物,其中最为大家熟知的就是“PD-1/PD-L1”,无数患者从中获益。这个“PD-1/PD-L1”其实是大家对于作用于PD-1/PD-L1通路的一系列药物的简称,主要包括PD-1抑制剂和PD-L1抑制剂。
但是也有一些患者朋友用了“PD-1/PD-L1”之后发现,疗效并不像传说的那么好,难道是“打开的方式不对”?真是小小的脑袋,大大的疑惑。
现在肿瘤的治疗已经进入了精准治疗时代,有很多的患者在开始治疗之前,都可以做基因检测帮助判断使用何种靶向药物更有效,有没有什么办法能够帮助患者在使用免疫治疗之前就判断疗效呢?以下这些可能是免疫治疗的疗效预测指标。
重点内容
大部分PD-L1表达量高的患者,获得了比表达量低的患者更好的疗效,尤其是PD-L1表达大于50%的患者;
肿瘤突变负荷(TMB)高,可能意味着免疫治疗疗效好,患者生存率高;
带有MSI-H(微卫星高度不稳定)或dMMR(基因错配修复功能缺陷)的肿瘤患者,使用免疫治疗或许能获得更好的疗效;
肿瘤浸润T细胞含量高,那它对免疫疗法的响应可能较高;
NLR<3的患者接受PD-1治疗可能有更好的治疗结果,反之,疗效则会大打折扣,生存期明显缩短;
或许前期治疗接受过放疗的患者,再使用PD-1的获益要大于未接收过放疗的患者;
有抽烟史的EGFR野生型非鳞非小细胞肺癌患者采用免疫治疗可能获益更大;

Pexels | Ekaterina Bolovtsova
1. PD-L1表达量
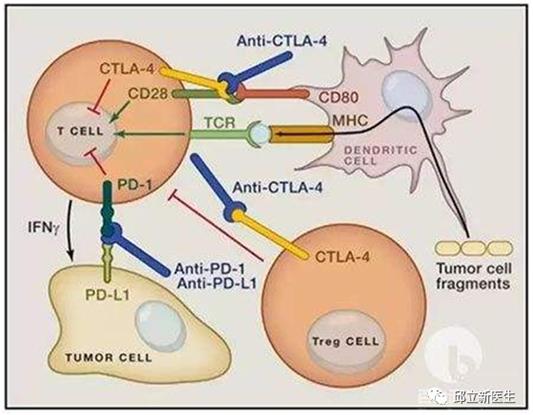
目前主流理论认为,部分肿瘤细胞通过高表达PD-L1蛋白来结合免疫细胞上的PD-1蛋白,从而抑制免疫细胞的攻击。而PD-1/PD-L1抑制剂的作用,正是打破这种PD-L1和PD-1的结合,从而激活免疫细胞,尤其是T细胞,完成对肿瘤细胞的攻击。顺着这种理论,有人猜想,如果肿瘤表达PD-L1越多,或许PD-1免疫药物效果越好。为什么呢?可以一起看一下详细的PD-1、PD-L1作用机制。
图片来源于网络,侵删
如上图所示:
PD-1主要在激活的T细胞和B细胞中表达,功能是抑制细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫病,所以PD-1是我们人体的一道护身符。但是,肿瘤微环境会诱导浸润的T细胞高表达PD-1分子,肿瘤细胞会高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活,就像踩下了T细胞的“刹车”,导致T细胞功能被抑制,无法杀伤肿瘤细胞。PD-1的抗体可以阻断这一通路,部分恢复T细胞的功能,使这些细胞能够继续杀伤肿瘤细胞。
PD-L1在多种肿瘤细胞中均有上调表达,它与 T细胞上的PD-1结合,抑制 T细胞增殖和活化,使T细胞处于失活状态,最终诱导免疫逃逸。
PD-1抗体和PD-L1抗体会选择性的结合T细胞表面的PD-1和肿瘤细胞表面的PD-L1,可有效阻断T细胞表面的PD-1和肿瘤细胞表面的PD-L1的结合,解除肿瘤细胞的“免疫逃逸”状态,上调T细胞的生长和增殖,增强 T细胞对肿瘤细胞的识别,激活其攻击和杀伤功能,通过调动人体自身的免疫功能实现抗肿瘤作用。
也有非常多的临床试验结论表明,患者PD-L1的表达量与疗效存在一定相关性
以“K药”为例:
2016年10月25日默沙东宣布,FDA批准Keytruda(pembrolizumab)用于一线治疗PD-L1表达水平≥50%且没有EGFR或ALK基因突变的转移性非小细胞肺癌(NSCLC)。用法为固定剂量200mg每3周1次,直至疾病进展、出现不可耐受毒性或24个月疾病无进展。Keynote001和Keynote010都是Keytruda针对非小肺癌的三期临床代号,分别招募495和1034名患者参与。根据临床数据,可以看到:随着PD-L1表达水平的提高,患者对keytruda的应答率、无进展生存期和中位生存期也在明显提高。尤其是Keynote001中,PD-L1表达大于50%的患者客观缓解率是45.3%,意味着接近一半的患者肿瘤都会缩小至少30%;而PD-L1表达小于1%的患者客观缓解率只有10.7%。
从以上临床试验可以看出,PD-L1表达量与“K药”疗效的正相关性,大部分PD-L1表达量高的患者,获得了比表达量低的患者更好的疗效,尤其是PD-L1表达大于50%的患者。
另一项针对皮肤黑色素瘤的研究也表明,PD-1抗体治疗PD-L1(-)皮肤黑色素瘤的有效率为26.2%(95%可信区间21.7%-30%),PD-L1(+)者有效率高达49.0%(95% CI 43.2%-54.9%),也许PD-L1表达量确实可以帮助大家提前预测“PD-1/PD-L1”的疗效。
2. 肿瘤突变负荷(TMB)
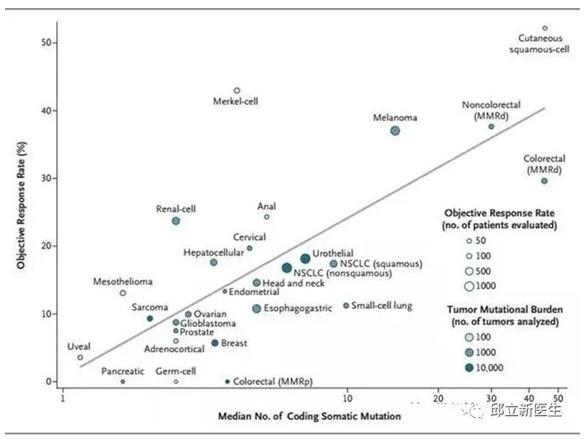
TMB就是肿瘤组织每兆碱基中突变的数目,一般这个指标是通过组织样本来检测的。形象地说当一个肿瘤细胞有更多的突变时,就越有可能产生更多的异常的蛋白质,它们细胞表面的蛋白可能显得更加的奇怪和显眼,更容易被免疫细胞识别和攻击。那TMB与PD-1治疗的有效率之间有何关系呢?
《新英格兰医学杂志》曾发表过一个有趣的数据,作者将TMB及PD-1治疗有效率的临床结果,汇成一张图,结果显示:各大常见肿瘤接受PD-1治疗的有效率和TMB大小几乎是线性关系。
图片来源于网络,侵删
CheckMate-032的临床试验,也有一些有趣的结果。这是一项纳入了401名一线治疗失败的晚期肺癌患者的II期临床试验,接受PD-1抑制剂单独或联合伊匹木治疗。按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23%,TMB高的人群组有效率明显高于其他两组;而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月TMB高的人群与TMB低的人群中位总生存期相差18.6个月。
Foundation Medicine的科学家研究过1638例测过TMB的病友,其中151例接受过PD-1抑制剂治疗。这151患者,按照TMB分成高、中、低三组,TMB高的人群,相比于另外两组(TMB低或中等)的病人,有效率(58% VS 20%)、无疾病进展生存期(12.8个月 vs 3.3个月)、总生存期(未达到 vs 16.3个月),均明显提高,甚至倍增。
看到这里,基本已经确定了TMB与免疫治疗疗效、患者存活率之间的关系:TMB高意味着,免疫治疗疗效好,患者生存率高。那么肿瘤突变负荷多高才算高呢?
一般认为
高:TMB>20突变/Mb
低:TMB<10突变/Mb
(Mb代表的是每百万个碱基)
3. MSI /MMR
MSI (microsatellite instability)是微卫星不稳定,MMR(mismatch repair)是指基因错配修复功能。人类错配修复基因(MMR基因)经转录翻译后可表达相应的错配修复蛋白,如果任一MMR蛋白表达缺失可造成细胞的错配修复功能缺陷,则对DNA复制过程中的碱基错配丧失修复功能而造成累积,导致微卫星不稳定(MSI)的发生,约15% 的结直肠癌是经由MSI途径引发的。MSI分为高度不稳定(MSI-H)、低度不稳定(MSI-L)和稳定(MS-S);MMR分为错配修复功能缺陷(dMMR)和错配修复功能完整(pMMR)。dMMR等同于微卫星高度不稳定(MSI-H), pMMR则等同于微卫星低度不稳定(MSI-L)或微卫星稳定(MSS)。
在2017年5月24日,Keytruda获FDA批准治疗带有MSI-H或dMMR变异的实体瘤患者。这意味着首款不针对肿瘤类型,而是针对肿瘤标记物的癌症治疗方法问世,在癌症史上具有划时代的意义。这也是FDA首次不依照病种,而是依照生物标志物核批的抗肿瘤疗法,也从一个侧面说明对于带有MSI-H或dMMR变异的癌症患者,Keytruda的治疗效果更佳。
FDA此次批准是根据一项有149名患者参与的临床试验结果决定的。这些患者一共患有15种不同类型的实体瘤,包括:子宫内膜癌、胆管癌、胃癌或者胃食管结合部肿瘤、胰腺癌、小肠癌、乳腺癌、前列腺癌、食管癌、腹膜后腺癌和小细胞肺癌,其中大部分患者都是结直肠癌(90名)。所有患者的肿瘤中都带有MSI-H或dMMR变异。患者每3周接受200mg K药或每2周接受10mg/kg K药治疗,直至疾病进展或毒性不可耐受。如果没有出现疾病进展或毒性仍可耐受,则一直治疗到24个月为止。一个独立的研究小组发现,患者客观缓解率为39.6%(95% CI:31.7%,47.9%),48名患者获得部分缓解,11名患者获得完全缓解,其中缓解时间达到半年以上的患者超过了78%。在90位结直肠癌患者中,患者缓解率为36%,其它14种不同癌症的患者(n=59例)总体缓解率为46%。肿瘤缓解的患者分别包括:结直肠癌(32例),子宫内膜癌(5例),胃癌或胃食管交界部癌(5例),胆管癌(3例),胰腺癌(5例),小肠癌(3例),乳腺癌(2例),前列腺癌(1例),食管癌(1例),后腹膜腺癌(1例),小细胞肺癌(1例)。
另一个让人欣喜的事实是,带有MSI-H(微卫星高度不稳定)或dMMR变异的肿瘤分布非常广泛,可出现在多个癌种中。也就是说,很多的肿瘤患者均有可能从免疫治疗中获益。而且在2019年ASCO大会上,来自美国纪念斯隆凯特林癌症中心的一个LBA(Late Breaking Abstract)的报告显示,采用二代测序的方法对来自>50个瘤种的>15,000个肿瘤标本进行微卫星的检测,结果发现,MSI-H肿瘤比例最高的是小肠肿瘤(25%,14/57)、子宫内膜癌(16%,86/525)、结直肠癌(14%,115/826)和胃癌(6%,13/211)。这个研究还发现在肾上腺皮质肿瘤中,MSI-H/MSI-I的肿瘤占40%(18/44),这是以前没发现过的。因此小肠癌、子宫内膜癌、结直肠癌和胃癌患者尤其需要检测MSI。
4.肿瘤浸润T细胞含量
肿瘤的炎性状态为biomarker探索带来启示。已有相关报道,免疫治疗的效果和肿瘤是否被免疫细胞浸润有关,若是肿瘤中无肿瘤浸润T细胞,PD-1抑制剂将毫无用武之地。所以,肿瘤组织中有丰富的T细胞,那它对免疫疗法的响应较高。T细胞炎性基因表达谱GEP可作为T细胞炎性肿瘤微环境(TME)的炎性Biomarker。
PD-L1和GEP都是指示TME的炎性生物标志物,而TMB和MSI-H是由体细胞肿瘤突变产生的肿瘤抗原性的间接评价指标。然而,这两类生物标志物之间的关系尚未得到很好的描述。
在一项新的研究中,研究人员在来自四项KEYNOTE临床试验的300多例患有22种肿瘤类型的晚期实体瘤和黑色素瘤的患者样本中,评估了利用TMB和 GEP联合预测对帕博利珠单抗作出临床反应的潜力。
结果显示,TMB和GEP仅表现出适度的相关性,并且独立地预测这些KEYNOTE临床试验数据集中的患者临床反应。在TCGA数据库中,GEP和TMB同样具有较低的相关性,这就证实了在不同癌症类型中联合使用GEP和TMB对转录组特征和基因组特征进行分类的潜力。
5.中性粒细胞-淋巴细胞比率(NLR)
NLR是指血常规中性粒细胞与其它淋巴细胞计数的比值,它是全身性炎症的标志物,并且与各种癌症患者的临床收益相关。
它还是预测癌症患者在化疗和分子靶向治疗中疗效的生物标志物。NLR高的癌症患者,无进展生存期(PFS)和总生存期(OS)较短;NLR低的患者,PFS和OS较长。
目前已经有很多证据显示,NLR<3的患者接受Opdivo治疗有更好的治疗结果,反之,疗效则会大打折扣,生存期明显缩短。
6.接受过放疗
全球著名的Lancet Onco杂志发表的KEYNOTE-001试验的后续研究报道发现:接受过放疗后继续使用Keytruda的患者疾病无进展时间(PFS)几乎是那些未接受过放疗直接使用Keytruda的患者的2倍(4.4个月vs2.1个月)。在总生存时间方面,前者也是后者的两倍(10.7个月vs 5.3月)。此外,是否接受过头部放疗意义重大,接受过头部放疗的患者有着更高的疾病无进展时间(6.3个月vs 2.0个月)和总生存时间(11.6个月vs5.3个月)。也就意味着,前期治疗接受过放疗的患者,或许使用PD-1的获益要大于未接收过放疗的患者。
7.是否有吸烟史
一项来自意大利的临床研究显示:抽烟的EGFR突变患者,靶向药耐药后,PD-1治疗的有效率高达20%。
该项涉及了1588位肺癌患者,要求患者至少是一次全身系统化疗失败,而且身体各项指标(肝肾功能等)符合PD-1的用药标准。PD-1抗体Opdivo治疗,剂量是3mg/kg,2周一次。
在这些患者中:有102位EGFR突变的患者,使用PD-1治疗的有效率只有8.8%;EGFR不突变的患者有1293位,PD-1治疗的有效率高达19.6%。所以,从总体来说,EGFR突变患者用PD-1治疗的效果比较差。但是,如果考虑这些EGFR突变患者是否抽烟,会得出很不一样的结论。
在这102位EGFR突变的患者中:有51位患者从来不抽烟,使用PD-1治疗之后,只有一位患者有效,有效率1.9%,中位生存期只有5.6个月;有34位患者曾经抽烟或者现在依然抽烟,PD-1治疗后,7位患者有效,有效率高达20.6%,中位生存期高达14.1个月。
在这些EGFR没有突变的患者中:有305位患者从来没抽过烟,PD-1治疗的有效率只有9.2%;1125位患者曾经抽过烟或者现在依然在抽烟,有效率高达21.5%。所以,从来不抽烟的患者使用PD-1治疗的效果比较差。
对于不抽烟的305位患者来说,EGFR突变的患者有效率只有1.9%,EGFR不突变患者的有效率也只有11%,都比较低;而对于抽烟的1125位患者来说,不管是否有EGFR突变,有效率都在20%以上。
根据这个临床数据,非鳞非小细胞肺癌患者对PD-1治疗的敏感性如下:
抽烟EGFR野生型患者(22%)>抽烟EGFR突变患者(20.6%)>不抽烟EGFR野生型患者(11%)>不抽烟EGFR突变患者(1.9%)所以,有抽烟史的EGFR野生型非鳞非小细胞肺癌患者采用免疫治疗可能获益更大。不过,邱医生不是鼓励大家去吸烟,而是想提示大家,如果您正好是有抽烟史的EGFR野生型非鳞非小细胞肺癌患者,那么还可以考虑用上免疫治疗。
Pexels | Aleksey Kuprikov
以上是一些可能的疗效预测因素,具备这些条件的患者在使用PD-1/PD-L1有可能会获得更好的疗效,但是,这些也仅能作为大家在选择治疗方案时的参考,并不绝对。因为目前在免疫治疗领域,暂时还没有权威认可的疗效预测指标,就以当前认可度较高的PD-L1表达量为例,将PD-L1作为PD-1抑制剂的临床生物标记物依然受到很大争议,主要就是因为它无法准确预测个体疗效。因为几乎所有临床试验中,我们都看到了某些PD-L1阴性的患者响应免疫疗法,我们也看到某些PD-L1强阳性的患者,一点效果都没有。单单以PD-L1表达量来预测疗效,似乎存在很大的不确定因素,原因有很多,主要还是以下两点:
第一是分布不均,PD-L1在肿瘤内部并非均匀分布,同一个肿瘤组织,可能一些部分表达阳性,一些部分表达阴性。这就带来了随机问题,因为取样可能取到阳性表达的部分,也可能取到阴性表达的部分。一块所谓“PD-L1阴性”的肿瘤组织,很可能换个地方取样检测,就是阳性的了。
第二是表达不稳定,PD-L1蛋白表达受到很多分子信号影响,会上下动态变化。一块看似表达低的肿瘤组织,或许第二天表达就高了。
TMB也是如此
不同年龄TMB不同:年龄高的患者TMB较高
不同癌种TMB不同:一些癌种的TMB明显高亍其它癌种
不同公司TMB不同:基于不同Panel和生物信息学算法
诸多的不确定因素,导致我们在开始治疗之前,无法十分确切的预测每一位患者的疗效,只能综合各方面因素,尽量选择适合患者实际情况的治疗方案。但是,相比于十几年前的“摸着石头过河”来说,肿瘤的治疗手段已经是迈上了一个很大的台阶,现在我们至少可以算作是“睁开了一只眼睛”,不足以窥全貌,但也是巨大的进步了,相信在不久的将来我们定能攻克癌症难以彻底治愈的难题。
转自邱立新医生微信公众号
