呋喹替尼联合信迪利单抗治疗晚期实体瘤的Ib/II期临床研究
本项目使用的两款药物分别为PD-1单抗信迪利单抗与VEGFR抑制剂呋喹替尼。前者由信达生物和礼来在中国合作开发,可与免疫T细胞表面的PD-1受体结合,阻断其与配体PD-L1之间的结合,使T细胞和自身免疫发挥正常作用,进而将肿瘤细胞消灭。后者为新型的高选择性小分子VEGFR1、2及3抑制剂,能通过抑制血管生成来抑制肿瘤生长。
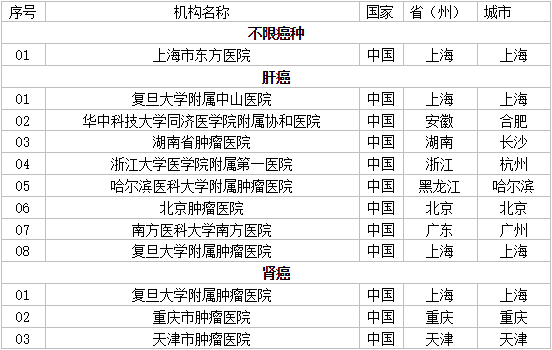
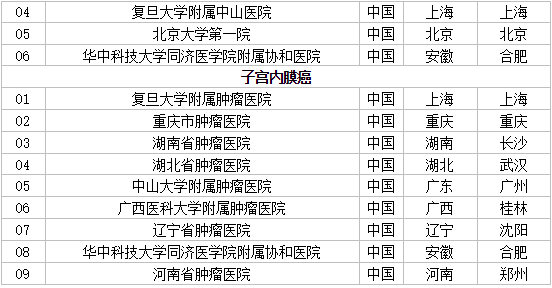
子宫内膜癌,肝癌,肾癌
主要入选标准:
1、年龄18-75周岁,BMI≥18.5,男女不限;
2、经组织学或细胞学确诊的不能手术 切除的或转移性晚期肝细胞癌[巴塞罗那临床肝癌 分期(BCLC分期)B期或C期丄或含透明细胞成分的晚期肾细胞癌,或晚期子宫内膜癌;
3、明确有符合实体瘤疗效评价标准(RECIST 1.1)要求的有可测量病灶(剂量递增阶段仅有可评价病灶也可以入组);如果既往接受过局部治疗(放疗、消融、介入治疗等)的病灶是唯一病灶,则必须有该病灶疾病进展的明确影像学依据;
4、患者同意提供组织标本用于检测PD-L1表达水平和/或微卫星不稳定性(MSI)或错配基因修复(dMMR)状态;
5、肝细胞癌患者接受过一种分子靶向治疗(索拉非尼或仑伐替尼)或/和系统化疗(亚碑酸单药或奥 沙利钳为主的联合用药);
6、肾细胞癌患者接受过一种标准的系统抗肿瘤治疗(舒尼替尼、索拉非尼、培哩帕尼、阿西替尼、卡博替尼、贝伐珠单抗联合IFN-a、替西罗莫司、白介素-2或IFN-a );
7、子宫内膜癌患者接受过一种全身性系统抗肿瘤治疗(激素治疗除外);
8、主要器官功能正常。
9、ECOG评分0-1。
主要排除标准:
1、既往或筛选时存在中枢神经系统(CNS)转移;
2、既往接受过任何抗PD-1抗体、抗PD-L1抗体、抗PD-L2 抗体或抗细胞毒T淋巴细胞相关抗原-4 (CTLA-4)抗体;(或作用于T细胞协同刺激或检查点通路的任何其它抗体)或吠哇替尼治疗;
3、存在任何活动性自身免疫性疾病或自身免疫性疾病病史, 包括但不限于间质性肺炎、葡萄膜炎、炎性肠道疾病、肝炎、垂体炎、血管炎、系统性红斑狼疮等(仅需要激素替 代治疗可以控制的甲状腺功能减退,仅需胰岛素替代治疗的I型糖尿病患者可纳入);
4、不能控制的恶性胸水、腹水或心包积液(定义为经研究者 判断不能通过利尿剂或者穿刺的方法得到有效控制);
5、患者目前存在胃及十二指肠活动性溃疡、溃疡性结肠炎等消化道疾病或未切除的肿瘤存在活动出血,或研究者判定 的可能引起消化道出血、穿孔的其他状况;或既往存在胃肠穿孔或胃肠道痿,经手术治疗后未痊愈者;