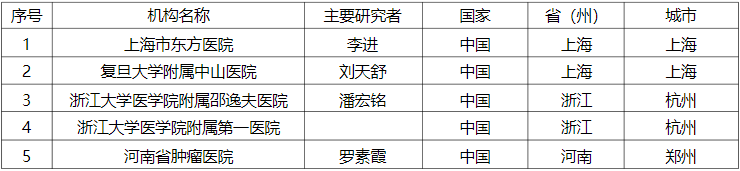
重组人源化抗Claudin 18.2单克隆抗体注射液治疗晚期恶性实体瘤的I期临床试验
Claudin(CLDN)是正常组织紧密连接最重要的一种蛋白质,其异构体CLDN18.2两种异构体仅在人胃上皮短寿细胞表面表达;但在胃癌、食管癌、胰腺癌、肺癌、卵巢癌、结肠癌等多种肿瘤中高表达,比如在50%-80%的胃癌患者存在该靶点的表达。因此,CLDN18.2可以成为胃癌、胰腺癌等实体肿瘤免疫治疗的有效靶标。重组人源化抗Claudin 18.2单克隆抗体注射液是我国自主研发的首个针对该靶点的单抗,也是国际上首个针对该靶点的人源化单抗,临床前研究结果显示其有良好的安全性和有效性。
标准治疗失败的晚期恶性实体瘤患者
主要入选标准:
1. 年龄18-80周岁,男女不限;
2. 经标准治疗失败,或无标准治疗方案,或没有条件接受标准治疗的经组织学或细胞学确认的晚期恶性实体瘤患者;
3. 肿瘤组织样本经中心实验室检测确定表达CLDN18.2;
4. 剂量递增阶段(阶段1),至少有一个可评估的肿瘤病灶;扩展阶段(阶段2)至少有一个可测量的肿瘤病灶;
5. ECOG体力评分0-1分;
6. 各器官功能状态良好: 有足够的肝肾功能,满足一定条件的血液系统及凝血功能。
主要排除标准:
1. 在首次使用研究药物前4周内接受过抗肿瘤治疗,除外以下几项:亚硝基脲或丝裂霉素C为首次使用研究药物前6周内,口服氟尿嘧啶类和小分子靶向药物为首次使用研究药物前2周或药物的5个半衰期内(以时间长的为准),有抗肿瘤适应症的中药为首次使用研究药物前2周内;
2. 具有临床症状的中枢神经系统转移或脑膜转移,或有其他证据表明患者中枢神经系统转移或脑膜转移灶尚未控制,经研究者判断不适合入组;
3. 目前或曾患有间质性肺病者;
4. 妊娠期或哺乳期女性。